眼科学の進歩は、基礎研究に裏付けられた臨床研究に依存していることは疑うべくもありません。しかし、最近では、臨床研究に関連する法令や指針が年々改正され、内容の理解に苦しむことも多くあります。そこで、現在の臨床研究の法令や指針について、簡単に整理してみたいと思います。
臨床研究の実施に際して遵守すべき法令や指針にはヘルシンキ宣言の倫理的原則をはじめとして、「個人情報保護法」、「臨床研究法」や「人を対象とする生命科学・医学系研究に関する倫理指針」などがあります。
平成30年4月1日に施行された臨床研究法では、臨床研究の質の向上、研究対象者の保護、製薬企業等の資金提供・労務提供にあたっての透明性の確保および臨床研究の実施機関における利益相反管理などについて制定されました。指針は行政指導であり強制力がないのに対して、臨床研究法は行政による法律に基づく調査権限・監視指導が可能になります。また、厚生労働大臣の認定を受けた審査委員会(認定臨床研究審査委員会:CRB)が実施計画や有害事象とその対応について審査します(図1)。
臨床研究法はいわゆる介入研究に適用されますが、なかでも、未承認・適応外の医薬品等の臨床研究と製薬企業等から資金提供を受けた医薬品等の臨床研究が「特定臨床研究」として定義され、実施にあたっては基準を遵守する義務を負います。臨床研究法の制定により当初の目的である研究の質の向上などについては達成できていると思いますが、一方で、事務手続きの煩雑さや研究にかかる費用が増大するために介入研究へのハードルが上がり、研究者のモチベーションを下げていることも否めません。
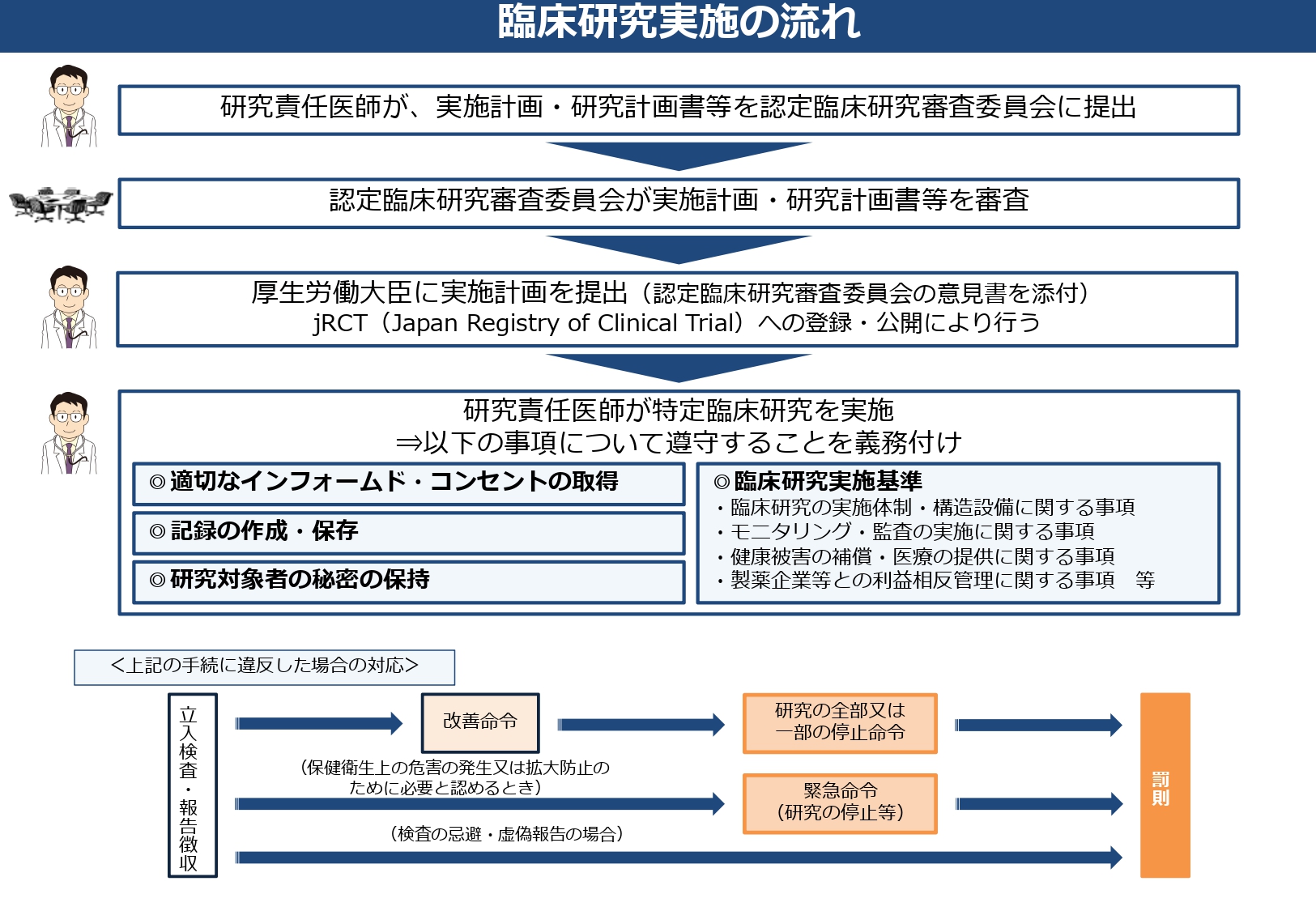
図1 臨床研究実施の流れ.
厚生労働省資料「臨床研究法の概要」(令和2年7月7日)より.
「人を対象とする生命科学・医学系研究に関する倫理指針」は、令和3年に施行されましたが、その内容は、「疫学研究に関する倫理指針」(平成14年)と「臨床研究に関する倫理指針」(平成15年)が統合された「人を対象とする医学系研究に関する倫理指針」(平成26年)と「ヒトゲノム・遺伝子解析研究に関する倫理指針」(平成13年)とが統合されたもので、これまで、何度も改正された内容をまとめたものとなっています(図2)。
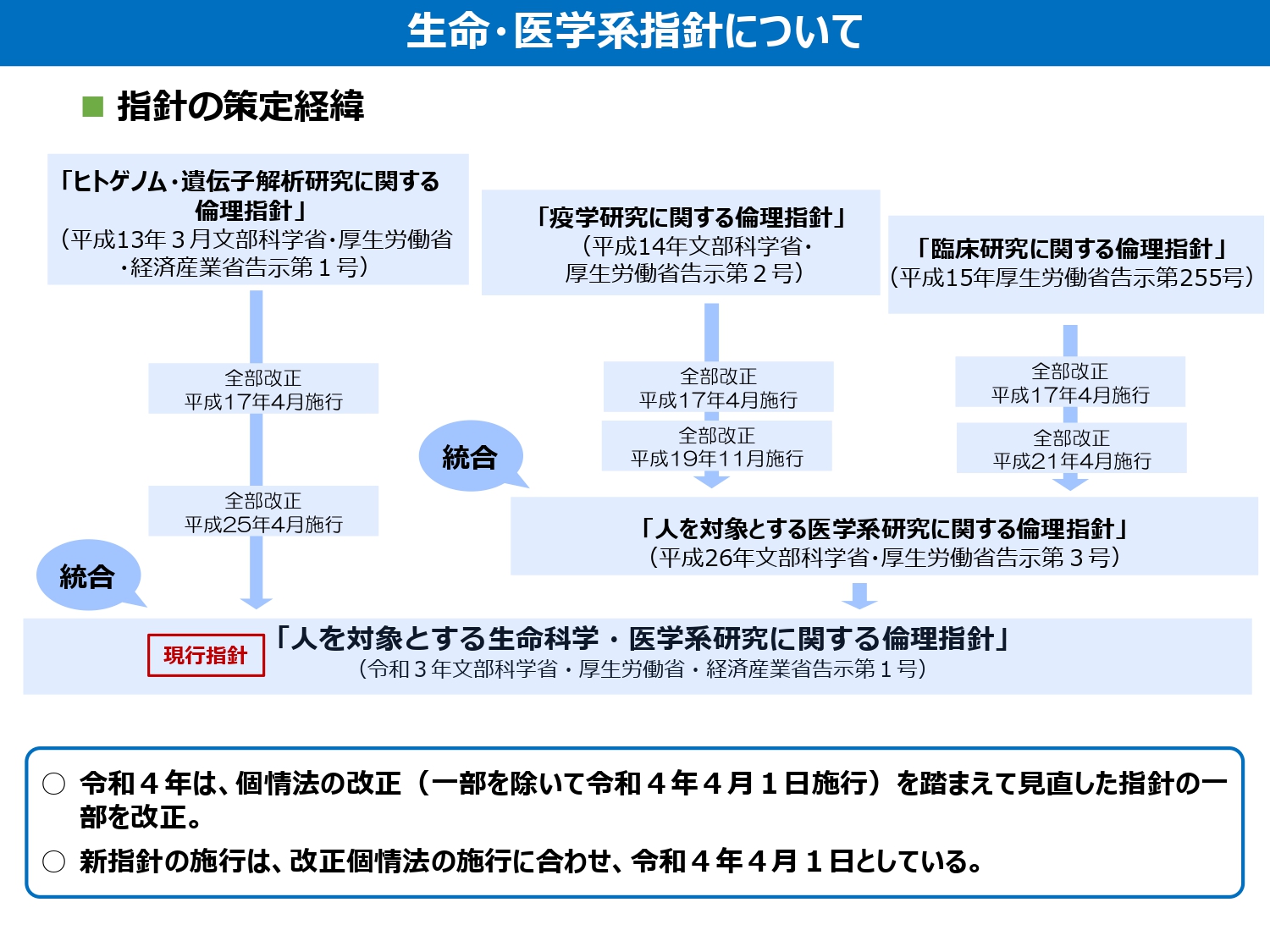
図2 指針の策定経緯.
文部科学省・厚生労働省・経済産業省資料「令和2年・3年個人情報保護法の改正に伴う生命・医学系指針の改正について」(令和4年3月)より.
さらに、今年4月1日から改正個人情報保護法が全面的に施行されました。これに合わせて、「人を対象とする生命科学・医学系研究に関する倫理指針」も一部改正が行われ4月1日より施行されています。しかし、本原稿執筆時には改正された指針の解説書である「ガイダンス」がいまだ公表されておらず、関係省庁との調整が続いている過去にない状態です。これは、今回の改正によって、研究対象者の同意を得ずに、院内掲示やホームページで研究内容を通知・公表するとともに研究対象者に研究参加の拒否の機会を保証すること(オプトアウト)で実施可能であった、コホート研究など、カルテ情報を使用する研究が大学や学会などの学術研究機関でしかできなくなったことのインパクトの大きさを示しています。
改正前、「オプトアウト」によってカルテ情報を使用できるのは、「学術研究その他特段の理由がある場合」として大学病院でも医院や診療所でも可能でしたが、改正後は「個人情報保護法」で定められた例外要件に該当する場合のみとなってしまいました。例外要件は、①学術研究機関等が学術研究目的に実施する場合と②公衆衛生上の例外として、死亡や転居により患者にアクセスできない場合です。①の学術研究機関等は個人情報保護法で厳密に規定されていて(文末の「参考」をご参照ください)、大学法人に属する大学病院と学会などだけが対象であり、それ以外の患者の診療を目的とする臨床病院は対象とはなりません。臨床病院で研究施設を持っている場合でも、学術研究機関として認めてもらうためには、内閣府の「個人情報委員会」に交渉して認めてもらう必要があります。なかなかハードルが高いです。
ただし、多機関での共同研究になると可能になることがあります。学術研究機関がデータセンターとして機能し、すべてのデータがその学術研究機関に集められる研究では、研究に参加している臨床病院でもオプトアウトが可能になります。また、個人情報保護法で規定する「適切な同意」を事前に取得しておけば、後ろ向き研究を実施するときに「研究対象者への通知」だけで実施できます。指針のガイダンスがまだ出ていないため、指針での「適切な同意」にどこまで含まれるか不明な点がありますが、「使用目的の明確化」が必要なため、過去に行われてきた「将来の研究に使用することがあります」といった漠然とした包括同意とは異なるようです。病院の事務手続き上、煩雑になるかもしれませんが、可能であればカルテ情報の使用については、「適切な同意」を事前取得しておくことも今後は必要かもしれません。
いずれにしても、今回の指針改正は臨床病院での医学研究の推進にとってはマイナス改正になってしまいました。
今後、学会からも患者の人権を守りながら活発で質の高い医学研究が推進できるようなしくみづくりを発信していくことが大切になるのではないでしょうか。
参考(個人情報保護法より抜粋):
-
「学術研究機関等」とは、大学その他の学術研究を目的とする機関若しくは団体又はそれらに属する者をいう。
- 「大学その他の学術研究を目的とする機関若しくは団体」とは、国立・私立大学、公益法人等研究所等の学術研究を主たる目的として活動する機関や「学会」をいい、「それらに属する者」とは、国立・私立大学の教員、公益法人等の研究所の研究員、学会の会員等をいう。
- 病院・診療所等の患者に対し直接医療を提供する事業者は「学術研究機関等」に該当しないが、例えば、大学附属病院のように学術研究機関等である大学法人の一部門である場合には、当該大学法人全体として「学術研究」を主たる目的とする機関として、「学術研究機関等」に該当する。
【続 報】
2022年5月26日付で、「個人情報の保護に関する法律についてのガイドライン」に関するQ&Aが更新され、オプトアウトに関わる部分の回答が見直されました。それによると、「同意を取得するための時間的余裕や費用等に照らし、本人の同意を得ることにより当該研究の遂行に支障を及ぼすおそれがある場合等」も同意困難に該当すると解釈が緩和されており、オプトアウトが可能になりました。